新冠肺炎疫情暴发后,防护口罩变成了实际中一罩难寻的日用必须品。中国也蜂拥而上发生了几千家的口罩生产公司,这种防护口罩公司有十分多的看准了现阶段肺炎疫情比较严重的欧盟国家地域,而欧盟国家销售市场的基本上认证规定便是CE认证。
大家也留意到现阶段市場上新近进行的医用口罩CE资格证书大部分全是根据欧盟国家医疗器械指令MDD 93/42/EEC开展派发的。殊不知这当中存有一个潜在性的困境:那便是市面上一部分防护口罩的CE资格证书很有可能也有一个多月就需要换版了。

有关MDR(EU 2017/745)剖析
2017年5月5日欧盟国家就公布了新版本医疗器械政策法规MDR(EU 2017/745)。在2017年5月25日,MDR宣布起效。老的医疗器械指令即MDD( 93/42/EEC)与新的MDR(EU 2017/745)指令的更替缓冲期为三年。
换句话说从2020年5月26日, MDR指令在欧盟国家就将逐渐申请强制执行,它将彻底替代以往老的医疗器械指令MDD (93/42/EEC)和老的数字功放嵌入医疗器械指令AIMDD(90/385/EEC)。
必须尤其强调的是:
☑ MDR申请强制执行后,新办理的CE认证务必依照MDR实行;
☑ 当今沒有CE资格证书的商品,自5月27日起,务必依照MDR认证;
☑ 2020年5月26前审签的MDD资格证书,在期限内依然可以用,最迟到2024年5月26日;
☑ 原来MDD资格证书需要在证书失效前换领 MDR。
5月26日起实行的欧盟国家MDR指令对现阶段医用口罩的CE认证实际会有什么危害?
1. 此次新冠疫情爆发期内所获CE认证的医用口罩,可以说95%之上的全是依照老的MDD指令开展的,很有可能要遭遇新版本换领难题;
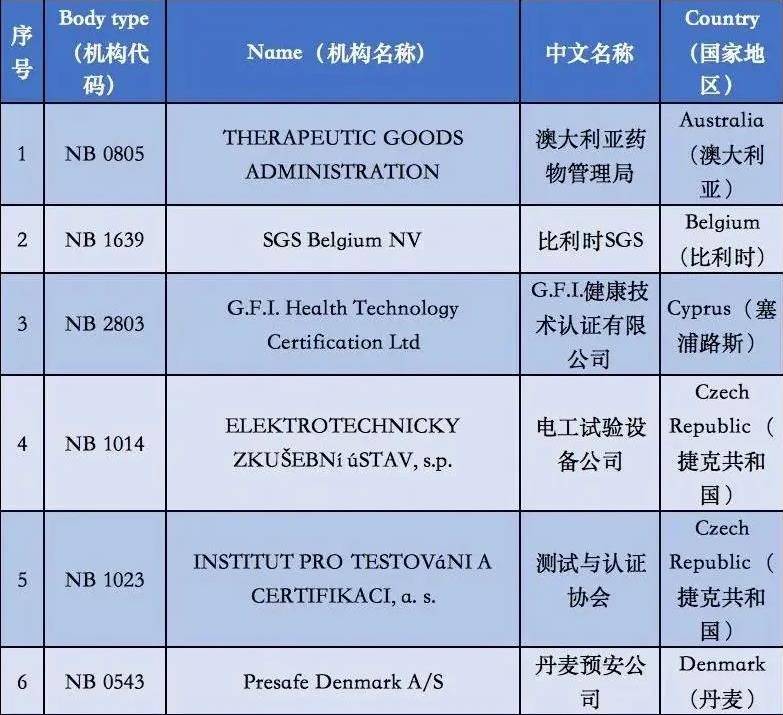
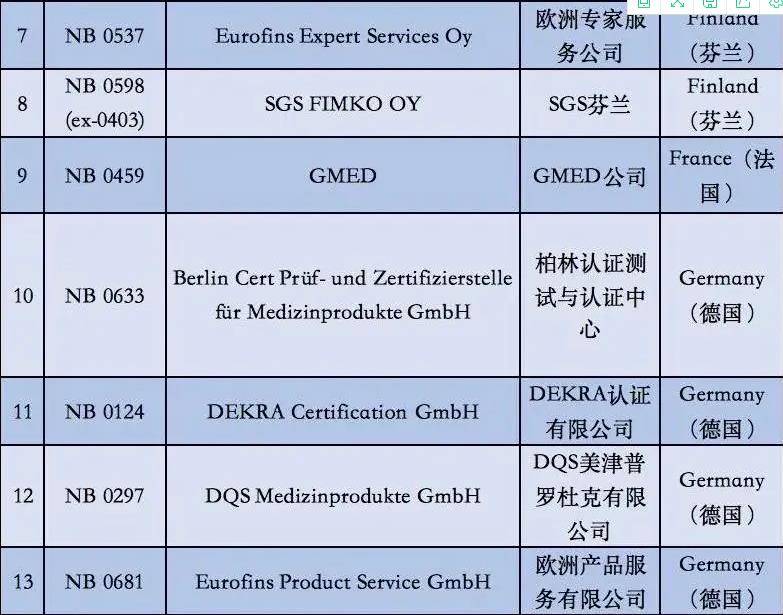
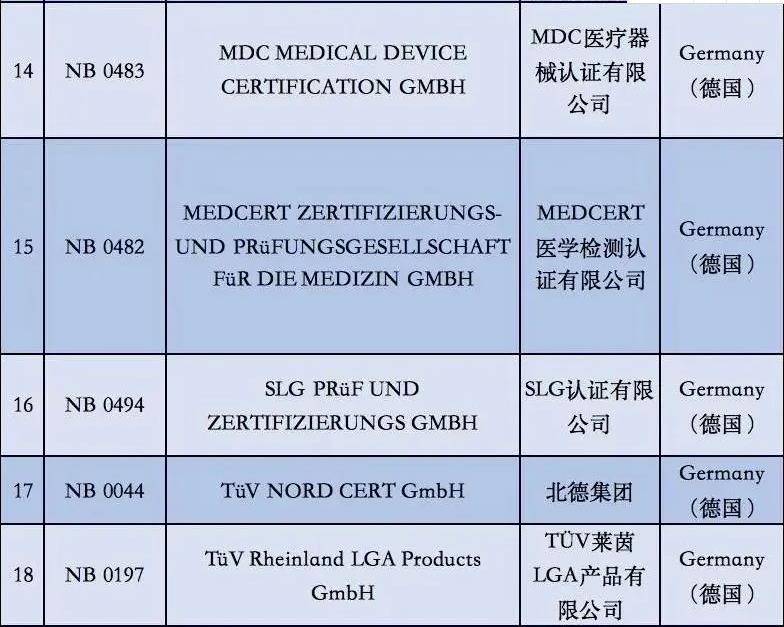
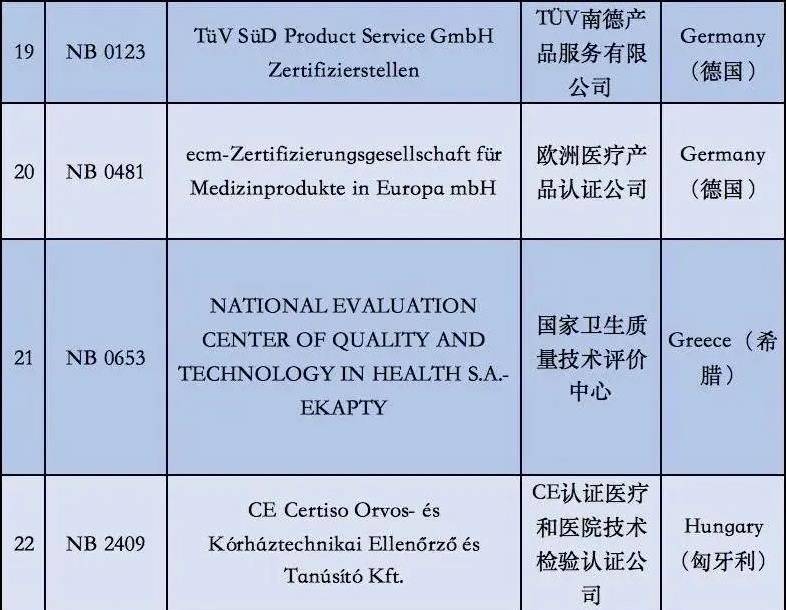
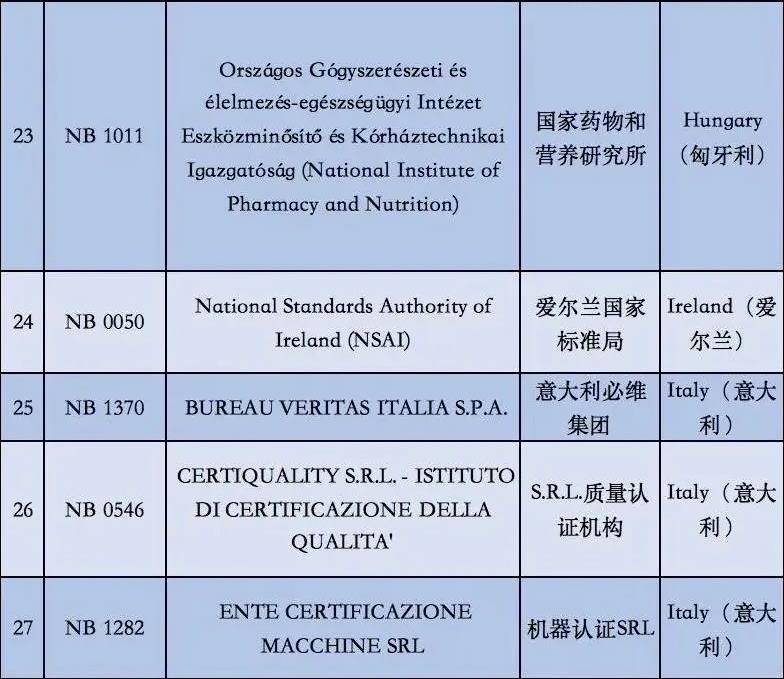
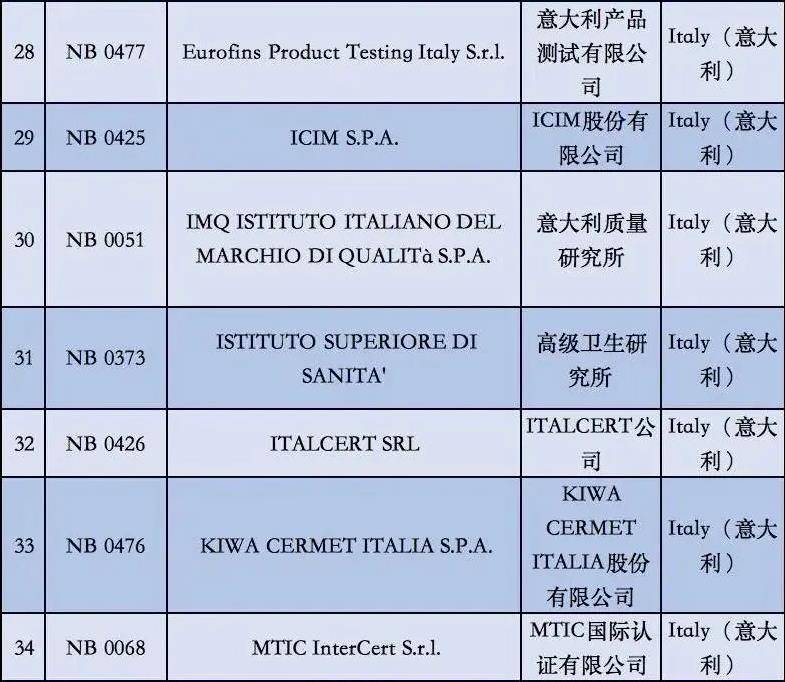
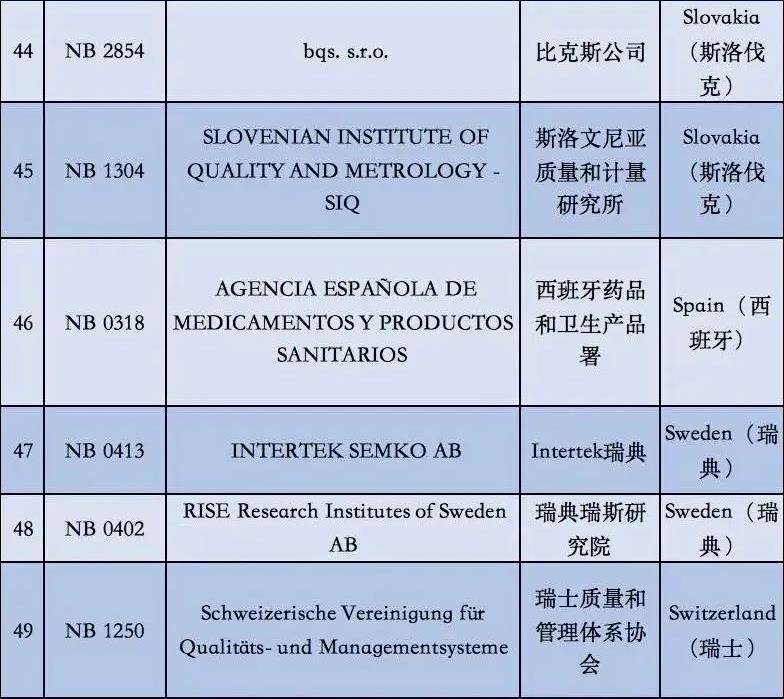
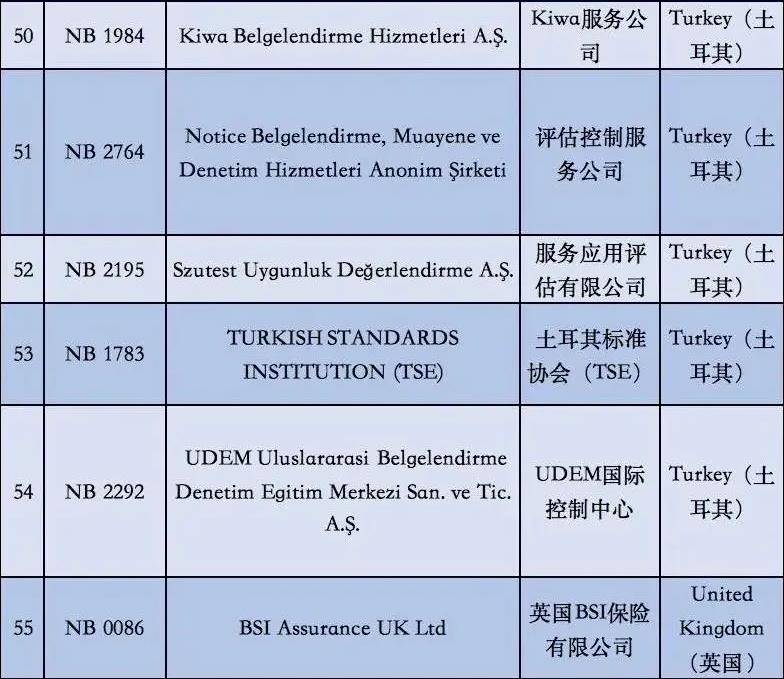
2. 依据现阶段欧盟国家全新统计分析,有着老指令版本号MDD(93/42/EEC)受权的NB公示组织一共有56家,而合乎MDR受权的NB公示组织现阶段则仅有12家罢了。换句话说,从2020年5月26日逐渐,对于医用口罩的CE认证审批组织易磨性减少了80%;
3. 因为欧盟国家MDR该类受权审批组织(NB:Notified Body)易磨性的降低,必定导致医用口罩CE认证花费非常大的几率将有大幅度提高的很有可能;
4. 新版本MDR指令审批规定比旧版MDD指令更加繁杂,认证周期时间必定大幅变长,此次肺炎疫情期内有一些组织宣称的几日拿证的几率将基本上为零;
5. 得到CE认证的防护口罩等医疗器械务必规定有选定的欧盟国家法定代理人(通称"欧代"),这在之前MDD指令时对一些低风险性商品实际上是否有欧代管控并不严苛,但在MDR指令后,即便 是在一些电子商务平台上开展市场销售的医疗商品也会需要给予必需的欧代信息内容;
6. MDR的管理体系审批步骤和需求更加繁杂与繁杂,举个事例当在MDR条文15中规定,医疗器械生产商应在其组织结构内,最少配置一名承担管控合规管理的工作人员,即合规管理责任人(Person responsible for regulatory compliance)。该工作人员应具有医疗器械行业的必需专业技能,而且有一系列的资质性证实规定(如法律法规、医药学、药理学、工程项目或其它有关课程,而且最少有着一年与医疗器械政策法规事务管理或品质管理方法管理体系有关的技术专业工作经验)。
7. 针对早已在欧盟国家方式正式上市的商品而言,老的MDD指令CE资格证书能够 维持到2024年5月26日。但假如公司产品在2021年5月26日前,仍未在欧盟国家市场的,正常情况下在2021年5月26日后需要将老的MDD资格证书再次申请办理调节到MDR版本号。
本次欧盟国家是立即公布的Regulation(政策法规),相较为以前的Directive(指令)其差别取决于:提升了约束,公布马上在欧盟国家起效并变成有约束的法律法规,本次的Regulation不用向Directive那般必须历经会员国转换成本地相关法律法规去贯彻落实执行。
因而,公司在申请办理医疗器械产品CE认证时,在转折期请慎重考虑到是采用全新政策法规或是选用老的指令计划方案,与此同时也必须对NB组织的颁证资质开展认识和确定以确保商品在欧盟国家市场的可延续性。
附①:2020年5月26日起12家MDR受权组织明细
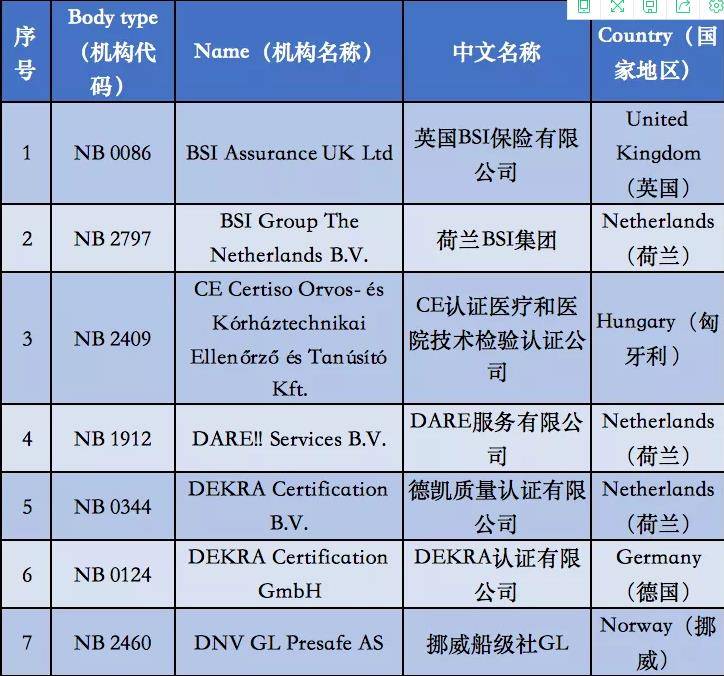
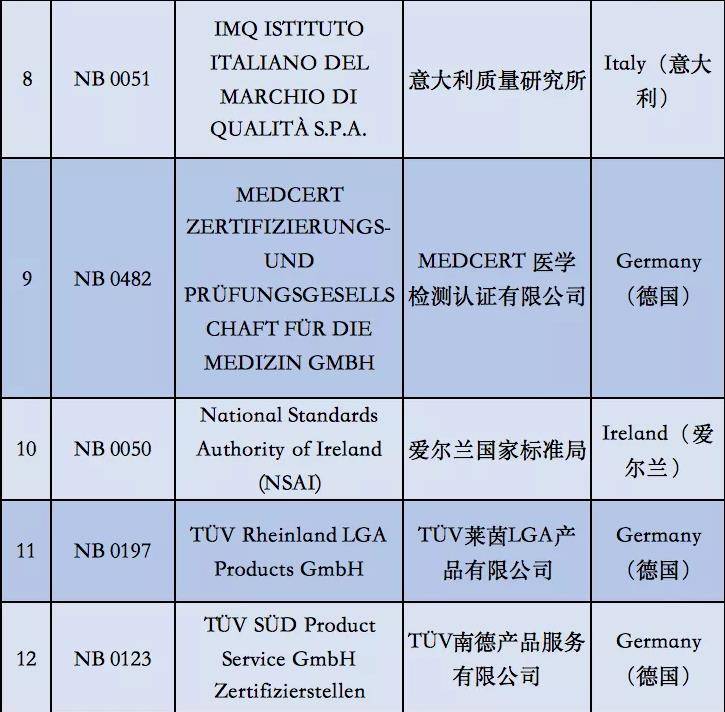
附②:2020年5月26日前56家MDD受权组织明细